O que são as forças de Van der Waals?
💡 3 Respostas
Evandro
Forças de Van der Waals são as interações intermoleculares (ou seja, que acontecem entre duas moléculas, composto iônico está fora) em que duas moléculas que não apresentam polaridade fazem uma "falsa ligação", ou seja, se atraem devido a eletrostáfica, formando uma interação. Esta interação é a mais fraca de todas as interações intermoleculares, sendo fácil de quebrá-la, ou seja, necessitamos de pouca energia.
marcelo borges do nascimento
As forças de Van Der Waals recebem definições diferentes a depender do autor consultado: uns a conceituam como interações intermoleculares fracas (dipolo-dipolo – forças de Keesom, de orientação -, dipolo-dipolo induzido – forças de Debye, de indução -, e dipolo instantâneo – dipolo induzido – interações de dispersão ou forças de London; outros trazem esse termo como sinônimo de forças de London.
De qualquer forma, as abordagens a seguir serão úteis para ambos os casos.
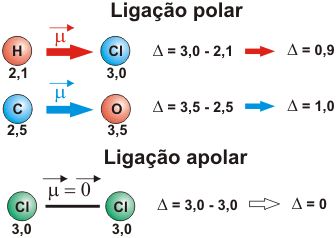
Momento de Dipolo
O vetor momento de dipolo de uma molécula é dado como o indicador da polaridade da mesma: semelhante a uma pilha (que apresenta dois pólos – negativo e positivo), uma molécula possui regiões onde a diferença de eletronegatividade entre átomos ligantes desloca a nuvem eletrônicapara um deles. Isso significa que o par de elétrons compartilhado estará na maior parte do tempo ao redor do mais eletronegativo – na mecânica quântica, diz-se que a densidade de probabilidade de encontrar os elétrons encontra-se maior na região onde a nuvem é mais notável (ao redor do átomo com maior eletronegatividade).
Essas regiões podem ser caracterizadas por uma parte positiva (onde a nuvem eletrônica é menos densa) e uma negativa (onde é mais densa), assim, um vetor pode ser utilizado para representar a diferença de potencial entre esses dois pontos: o vetor nasce no pólo positivo e é direcionado para o negativo.
A molécula é dita polar quando a soma desses vetores produz um vetor resultante de módulo diferente de zero; o contrário vale para uma molécula apolar, onde a soma dos vetores de cada região (delimitada por dois átomos ligantes entre si) resulta num vetor cujo módulo é igual a zero.
Interações Intermoleculares
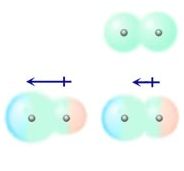
Dipolo-dipolo
Interações desse tipo são características de substâncias constituídas por moléculas polares, onde o pólo positivo de uma molécula liga-se com o pólo negativo de outra. Assim repetindo-se indefinidas vezes.
Dipolo-dipolo induzido
As interações dipolo permanente – dipolo induzido são observadas quando uma molécula polar deforma a nuvem eletrônica de uma molécula apolar. Assim, induz a formação de um dipolo.
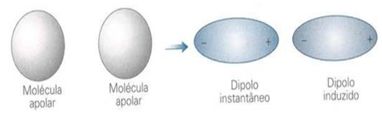
Dipolo instantâneo – dipolo induzido
Os elétrons que constituem a nuvem eletrônica de uma molécula estão em constante movimento, assim, se pudéssemos tirar fotografias dessa nuvem, elas não representariam a mesma imagem.
Ou seja, em moléculas apolares, há possibilidade de tornar-se polar durante um curto período de tempo. Entretanto, esse tempo é o bastante para que deforme a nuvem de outra molécula apolar e induza-a, de modo a formar dois pólos distintos (positivo e negativo). Tendo assim um dipolo induzido.
Verifica-se que a polarizabilidade de uma molécula apolar cresce com o seu tamanho, pois os elétrons da nuvem circundante encontram-se menos atraídos pelo núcleo. Por exemplo: o flúor se encontra no estado gasoso nas CNTP ao ponto que o iodo está no estado sólido.
Como a molécula de iodo é bem maior que a de flúor, é mais facilmente polarizável, assim, mesmo que as duas sejam apolares, as interações dipolo instantâneo – dipolo induzido são mais intensas na primeira substância.
Fontes:
ATKINS, Peter. LORETTA, Jones. Princípios de química: questionando a vida moderna e o meio ambiente; tradução Ricardo Bicca de Alencastro. – 3ª Ed. – Porto Alegre: Bookman, 2006. 968 páginas.
RD Resoluções
As Forças de Van der Waals ,são forças que atraem neutras moléculas para uma outra em estufa , em gases liquefeitos e solidificado, e em quase todos os orgânicos líquidos e sólidos . Os sólidos que são mantidos juntos pelas forças de van der Waals possuem, caracteristicamente, pontos de fusão mais baixos e são mais macios do que aqueles mantidos juntos pelas ligações iônicas , covalentes e metálicas mais fortes .
As forças de Van der Waals podem surgir de três fontes. Primeiro, as moléculas de alguns materiais, embora eletricamente neutras, podem ser permanentesdipolos elétricos . Devido à distorção fixa na distribuição decarga elétrica na própria estrutura de algumas moléculas, um lado de uma molécula é sempre um pouco positivo e o lado oposto um pouco negativo. A tendência de tais dipolos permanentes se alinharem resulta em uma força atrativa atrativa . Em segundo lugar, a presença de moléculas que são dipolos permanentes distorce temporariamente a carga de elétrons em outras moléculas polares próximas ou não polares, induzindo assim mais polarização.
Uma força atrativa adicional resulta da interação de um dipolo permanente com um dipolo induzido vizinho. Terceiro, embora nenhuma molécula de um material seja dipolo permanente (por exemplo, no gás argônio nobre ou no benzeno líquido orgânico), existe uma força de atração entre as moléculas, responsável pela condensação ao estado líquido em temperaturas suficientemente baixas .
✏️ Responder
Para escrever sua resposta aqui, entre ou crie uma conta.







Compartilhar