Qual mecanismo de ação do sistema nervoso simpático nos rins para evitar a perda de líquidos do organismo.
💡 1 Resposta
Rayne Pires
Processamento renal dos líquidos corpóreos
Filtração glomerular
Aproximadamente, 170 L de água salgada extracelular contendo mais de 25.000 mmol de sódio são filtrados pelo glomérulo a cada dia. Embora a pressão hidrostática glomerular seja consideravelmente maior do que pressão dos demais leitos capilares, a filtração glomerular também é dirigida pelas forças de Starling, que controlam a movimentação de líquidos entre os compartimentos intravascular e intersticial. O filtrado glomerular contém as mesmas concentrações de sódio e outros solutos que o líquido intersticial, além de ser praticamente isento de proteínas.
Reabsorção tubular
Considerando uma dieta convencional, todo o líquido, exceto cerca de 2 L de líquido filtrado e aproximadamente 175 mmol de sódio filtrado são reabsorvidos pelos túbulos renais. A regulação da reabsorção tubular de sais e água é fundamental para a regulação renal do equilíbrio dos líquidos corpóreos.4
No final do túbulo proximal, o filtrado remanescente apresenta a mesma concentração de sódio que o plasma. Conforme o filtrado passa pelos segmentos tubulares subsequentes, sua composição vai sendo significativamente alterada. Nesses segmentos mais distais, a reabsorção de sódio não está acoplada à reabsorção da água, de modo que a água pode ser reabsorvida sem sal. Assim, dependendo das condições, a concentração de sódio na urina final pode variar de menos de 1 mEq/L a quase 300 mEq/L, enquanto a osmolalidade urinária pode variar de 1/6 (50 mOsm/kg) a 4 vezes (1.200 mOsm/kg) a osmolalidade plasmática.
O processo de reabsorção do sódio é mediado pelos transportadores ou canais que ficam imersos nas membranas luminal e basolateral (voltada para o sangue) das células tubulares. Em cada segmento do néfron, a reabsorção de sódio é alimentada pela Na+/K+ -ATPase, que está localizada no lado da célula tubular voltado para o sangue.A bomba de sódio o exporta da célula, reduzindo a concentração intracelular desse cátion. A menor concentração celular de sódio gera um gradiente eletroquímico que movimenta o sódio presente no lúmen tubular para dentro da célula. Em várias regiões ao longo do néfron, os segmentos tubulares utilizam diferentes mecanismos luminais para a reabsorção de sódio Trocadores luminais, cotransportadores e canais iônicos localizados ao longo do néfron estão sujeitos ao controle fisiológico, podendo ser farmacologicamente inibidos por agentes diuréticos específicos.5 Mutações afetando essas proteínas de transporte são responsáveis por distúrbios clínicos já bem definidos.6
A membrana luminal do ducto coletor é impermeável à água na ausência de arginina vasopressina – um hormônio antidiurético (ADH – do inglês antidiuretic hormone). Desse modo, quando os níveis plasmáticos de ADH estão baixos, esse segmento reduz progressivamente a osmolalidade e a concentração de sódio da urina final, permitindo a excreção de grandes volumes (até 20 L diários) de urina diluída. Na presença de ADH, os canais de água – chamados aquaporinas – são inseridos na membrana luminal do túbulo distal e do ducto coletor.7,8 Quando os níveis plasmáticos de ADH estão altos, a água é osmoticamente atraída do lúmen tubular para o interstício medular hipertônico, permitindo a excreção de um pequeno volume (até 0,5 L diário) de urina concentrada.
Tabela 1. Transporte de sódio em diferentes segmentos do néfron.
|
Segmento do néfron |
Filtrado glomerular reabsorvido (%) |
Mecanismo de entrada do sódio luminal |
Regulação fisiológica |
Sítio de ação do diurético |
|
Túbulo proximal |
60-70 |
Troca Na+-H+; cotransporte com glicose e outros solutos orgânicos |
Angiotensina II; nervos renais; forças de Starling peritubulares |
Inibidores da anidrase carbônica (p. ex., acetazolamida) |
|
Alça de Henle |
20-25 |
Cotransporte Na+-K+-2Cl |
Dependente do fluxo; forças de Starling peritubulares |
Diuréticos de alça (p. ex., furosemida, bumetanida, ácido etacrínico) |
|
Túbulo distal |
5 |
Cotransporte Na+-Cl |
Dependente do fluxo |
Diuréticos tiazídicos |
|
Túbulo coletor |
4 |
Canais de Na+ |
Aldosterona; fator natriurético atrial |
Diuréticos poupadores de potássio (p. ex., amilorida, triamterene, espironolactona) |

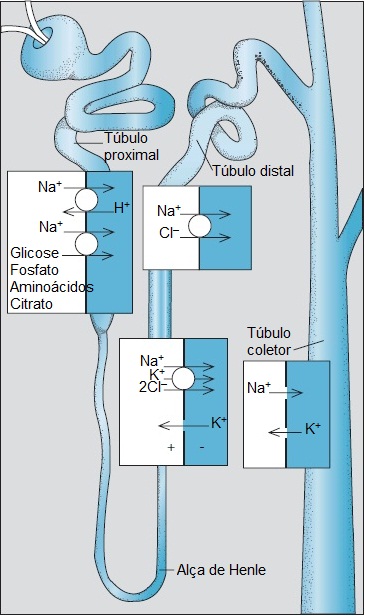
Figura 2. Em cada segmento tubular, o sódio entra passivamente na célula, seguindo o gradiente eletroquímico favorável criado pela bomba Na+/K+-ATPse. A entrada do sódio luminal ocorre através de um mecanismo diferente que atua em cada um dos segmentos do néfron. O túbulo proximal reabsorve o bicarbonato filtrado e outros solutos, tais como glicose, fosfato, aminoácidos e citrato. Um transportador de Na+-K+-2Cl- medeia a entrada do Na+ no braço ascendente da alça de Henle. O túbulo distal apresenta um cotransportador de Na+/Cl-. O Na+ entra nas células principais do ducto coletor cortical através de canais de Na+existentes na membrana luminal.
Regulação dos volumes de líquidos corpóreos
A água salgada (salina isotônica) fica confinada ao espaço extracelular. Seu acúmulo expande o volume extracelular, enquanto a perda causa depleção de volume. Em ambos os casos, alterações do equilíbrio da água salgada não modificam a concentração plasmática de sódio nem o volume celular. Em contrapartida, a água isenta de eletrólitos (ou água pura) está distribuída em todos os líquidos corpóreos, afetando os compartimentos líquidos extra e intracelular. Como apenas 1/3 do conteúdo de água corpórea é extracelular, a água isenta de eletrólitos exerce apenas o equivalente a 1/3 do impacto exercido pela água salgada sobre o volume extracelular. Todavia, diferente do equilíbrio da água salgada, o equilíbrio da água livre de eletrólitos exerce impacto significativo sobre a concentração plasmática de sódio, tonicidade líquida corpórea e volume celular.
Os volumes de líquidos extra e intracelular são mantidos por sistemas de controle separados que interagem entre si O sistema extracelular regula primariamente a excreção urinária de sódio, enquanto o sistema intracelular regula a captação e excreção de água. O volume de líquido extracelular mantém o grau adequado de repleção vascular – uma variável sensível aos receptores de estiramento atriais e barorreceptores arteriais. O volume intracelular é regulado pelas células osmorreceptoras hipotalâmicas que inflam ou encolhem em resposta às alterações da tonicidade plasmática.
Tabela 2. Controle dos volumes de líquidos corpóreos
|
|
Equilíbrio da água salgada |
Equilíbrio da água isenta de eletrólitos |
|
|
Dia a dia |
Recuperação emergencial |
||
|
Variável regulada |
Volume extracelular Plenitude vascular |
Volume celular |
Enchimento arterial |
|
Indicador clínico |
Pressão arterial Edema |
Concentração plasmática de sódio |
Pressão arterial Edema |
|
Sensores |
Barorreceptores, receptores de volume atriais |
Osmorreceptores hipotalâmicos |
Barorreceptores, receptores de volume atriais |
|
Mediadores |
Sistema da renina-angiotensina-aldosterona Sistema nervoso simpático Peptídeo natriurético atrial Forças de Starling nos capilares peritubulares |
Hormônio antidiurético (arginina vasopressina) Sede |
Hormônio antidiurético (arginina vasopressina) Sede |
|
Variável afetada |
Excreção urinária de sódio |
Osmolalidade urinária Ingesta de água |
Osmolalidade urinária Ingesta de água |
Controle do volume de líquido extracelular
Num indivíduo saudável, a quantidade de sódio presente no espaço extracelular pode variar consideravelmente, dependendo da ingesta dietética de sal. Entretanto, a concentração extracelular de sódio permanece quase constante, graças aos sistemas de controle fisiológicos, que regulam intensamente a ingesta e excreção da água. Em indivíduos sadios, o aumento do conteúdo de sal do espaço extracelular corresponde à expansão do volume de líquido extracelular, enquanto a diminuição desse conteúdo corresponde a um volume extracelular menor. No entanto, seja qual for o caso, a concentração extracelular de sódio permanece a mesma.
O equilíbrio do sódio e o volume intravascular são afetados por numerosos mediadores hormonais e não hormonais. Em adição à aldosterona e à angiotensina – os mediadores da excreção de sódio mais conhecidos – o sistema nervoso simpático, peptídeos natriuréticos e alterações da circulação renal exercem, todos, papéis regulatórios importantes 9 Dada a redundância e a sobreposição associadas ao sistema de controle, a falha de um único fator não acarreta anormalidades sustentadas importantes do volume intravascular. A relativa importância dos vários mediadores que afetam a excreção urinária de sódio ainda é parcialmente compreendida, sendo provável que existam alguns fatores reguladores do sódio ainda não descobertos.
Controle do volume de líquido intracelular
O equilíbrio da água e do volume celular são controlados por um único mediador hormonal – a arginina vasopressina (ADH) [ver Reabsorção Tubular acima] – que é liberado na circulação sistêmica pela neuro-hipófise O hormônio ativa receptores V2 localizados na membrana basolateral das células principais, no ducto coletor renal, iniciando um processo cíclico dependente de monofostato de adenosina (cAMP-dependente) que culmina na inserção de canais de água (aquaporinas) nas membranas luminais celulares.7,8 A modulação do número de aquaporinas controla a osmolalidade urinária e a taxa de excreção de água pelos rins. A curta meia-vida da vasopressina na circulação e a contínua movimentação das aquaporinas entre a membrana e o citosol das células do ducto coletor garantem que a excreção urinária de água responda rapidamente às alterações da tonicidade dos líquidos corpóreos.
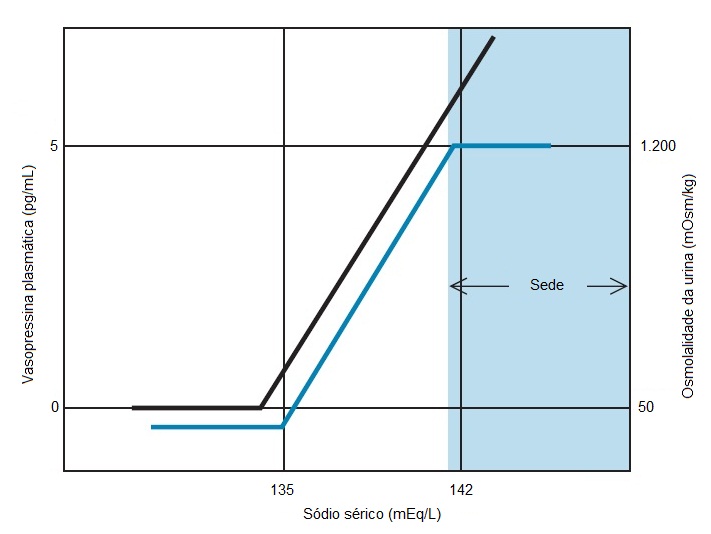
Os níveis de vasopressina normalmente são imensuráveis quando a concentração plasmática de sódio atinge níveis inferiores a 135 mEq/L Baixos níveis de hormônio resultam na excreção de grandes volumes de uma urina maximamente diluída (50 mOsm/kg). Diante de níveis de sódio acima de 135 mEq/L, os níveis plasmáticos de vasopressina mostram-se linearmente relacionados à concentração plasmática de sódio e aumentam de forma mensurável em resposta a alterações da ordem de 1 mEq/L na concentração plasmática desse cátion. Uma vez que a concentração plasmática de sódio atinge níveis aproximados de 142 a 144 mEq/L, os níveis de vasopressina tornam-se altos o bastante para promover a excreção de uma urina maximamente concentrada (1.200 mOsm/kg). Uma elevação da concentração plasmática de sódio também faz com que os receptores hipotalâmicos de volume celular retransmitam sinais nos centros da sede adjacentes. Modulada pela sede e por alterações da secreção de vasopressina, a concentração plasmática de sódio normalmente fica impedida de atingir valores acima de 144 mEq/L ou inferiores a 135 mEq/L.
Sob as condições do dia a dia, a ingesta de água, secreção de vasopressina e excreção urinária de água livre respondem primariamente às alterações da concentração plasmática de sódio causadas pelas variações do equilíbrio da água isenta de eletrólitos. Diferentemente da excreção de sódio, que é afetada somente por alterações do volume intravascular, a excreção de água livre pode ser afetada por dois tipos de estímulos: o volume intravascular e a tonicidade. Sob condições patológicas, o controle osmótico da secreção de vasopressina e a sede podem ser substituídos por estímulos hemodinâmicos. Os neurônios hipotalâmicos que secretam a vasopressina recebem sinais neurais provenientes dos barorreceptores localizados em vasos de grande calibre, bem como dos receptores de volume situados nos átrios. Quando esses receptores são estimulados pela hipotensão ou por uma redução significativa do volume plasmático, os impulsos gerados são transportados pelos IX e X nervos cranianos. A vasopressina e as respostas de sede à hipovolemia e à hipotensão podem ser consideradas sistemas de recuperação, cuja função é manter o volume de sangue arterial diante de condições emergenciais, sacrificando a tonicidade em prol da perfusão tecidual.

Clique na imagem para ampliar
Figura 3. O gráfico representa a relação normal existente entre os níveis plasmáticos de vasopressina, osmolalidade da urina (linha preta) e concentração plasmática de sódio (linha azul). Os níveis plasmáticos de vasopressina mudam em questão de minutos em resposta às alterações de sódio plasmático. A osmolalidade da urina muda em poucos minutos em resposta às alterações ocorridas nos níveis de vasopressina. Quando a hidratação reduz os níveis plasmáticos de sódio a valores abaixo de 135 mEq/L, a vasopressina plasmática se torna indetectável e a urina é maximamente diluída (osmolalidade de 50 mOsm/kg). Diante de concentrações de sódio entre 135 e 142 mEq/kg, os níveis de vasopressina apresentam relação linear com o sódio plasmático, produzindo um aumento na osmolalidade da urina de quase 100 mOsm/kg para cada aumento de 0,5 mEq/L na concentração de sódio. Quando a concentração plasmática de sódio se torna maior que 142 mEq/L, a urina é maximamente concentrada. O aumento da ingesta de água mediado pela sede, então, se torna a principal defesa contra a hipernatremia progressiva.
Regulação do volume celular na hipo e na hipertonicidade
O volume celular é determinado pela quantidade e concentração intracelular de solutos. Como as concentrações intra e extracelular de solutos devem ser iguais, a relação existente entre água celular e osmolalidade extracelular pode ser descrita pela seguinte equação:
Água celular = conteúdo celular de solutos/osmolalidade extracelular
Normalmente, a ingesta e a excreção de água são moduladas para manter a tonicidade líquida corpórea junto à estreita faixa fisiológica. Entretanto, sob condições patológicas, as células do corpo podem ser expostas a um milieu hipo ou hipertônico.10 A primeira resposta ao estresse osmótico é um ajuste compensatório dos eletrólitos intracelulares: perda de potássio na hipotonicidade, e acúmulo de sódio e potássio na hipertonicidade. Com o passar do tempo, as alterações envolvendo os solutos orgânicos dominam a resposta.
A maioria das células mantém concentrações relativamente altas de pequenas moléculas orgânicas osmoticamente ativas. Os osmolitos orgânicos são solutos que não causam perturbação. Diferentemente do sódio e do potássio, suas concentrações intracelulares podem variar amplamente sem afetar a estrutura terciária da proteína. As células acumulam osmolitos orgânicos sob condições hipertônicas, assim como os perdem diante da hipotonicidade.
A necessidade de regulação do volume celular é mais imperativa no cérebro, onde a rígida calota craniana impõe uma forte limitação ao grau de expansão ou contração tecidual que pode ser tolerado.10-13 Um aumento do conteúdo de água cerebral superior a aproximadamente 5 a 10% é incompatível com a vida. Variações da concentração intracelular de osmolitos orgânicos proporcionam ao cérebro uma surpreendente capacidade de adaptação a distúrbios osmóticos crônicos. Entretanto, como as alterações do conteúdo de osmolitos das células cerebrais requerem poucos dias para se desenvolver totalmente, o cérebro é ameaçado pelas alterações osmóticas rápidas. Assim, a hipo ou hipernatremia aguda podem ser condições fatais diante de concentrações plasmáticas de sódio que seriam cronicamente bem toleradas.
Nos casos de distúrbios osmóticos sustentados, as adaptações que protegem contra o inchaço e encolhimento cerebral também predispõem à lesão quando o distúrbio osmótico é subitamente corrigido. Na hiponatremia crônica, os solutos celulares perdidos na fase adaptativa devem ser recuperados quando a concentração plasmática de sódio volta ao normal – um processo que pode demorar vários dias. A menos que a recuperação de solutos acompanhe o ritmo da elevação da osmolalidade extracelular, as células cerebrais se tornarão desidratadas.11,12Esse fenômeno pode causar complicações clínicas [ver Complicações da terapia: mielinólise e síndrome da desmielinização osmótica, a seguir]. De modo semelhante, na hipernatremia crônica, os solutos acumulados devem ser perdidos durante a correção do distúrbio de eletrólitos.10,13 As células que foram condicionadas a um ambiente hipertônico perdem os osmolitos orgânicos lentamente, devido à lenta renovação do mecanismo de efluxo, lenta modulação negativa das vias de captação hipertonicamente estimuladas, ou a ambos os processos. Assim, quando a hipernatremia crônica é corrigida rapidamente, as células cerebrais incham e seus volumes se tornam maiores do que o volume normal.
Distúrbio do excesso de água: hiponatremia
Hiponatremia significa apenas uma baixa concentração plasmática de sódio. Na maioria dos casos, a hiponatremia está associada a um baixo nível de osmolalidade plasmática e a líquidos corpóreos excessivamente diluídos (hiponatremia hipotônica). Entretanto, existem exceções a essa regra [ver Diagnóstico diferencial para hiponatremia, adiante].
Patogênese da hiponatremia
A hiponatremia hipotônica resulta de dois mecanismos básicos, seja individualmente ou juntos: (1) ingesta maciça de água, que excede a capacidade de excreção da água isenta de eletrólitos; ou (2) comprometimento da excreção de água. Quando normal, a capacidade de excreção da água é bastante ampla. Na ausência da vasopressina, a osmolalidade da urina cai para aproximadamente 50 mOsm/kg. Uma típica dieta norte-americana fornece 600 a 900 mOsm de eletrólitos e ureia, que devem ser excretados diariamente. Para essa taxa de excreção de solutos, o volume da urina maximamente diluída é igual a 12 a 18 L. A ingesta de água ocasionalmente pode exceder a capacidade normal de excreção, sobretudo em pacientes psicóticos (que freneticamente ingerem galões de água em poucas horas)14 e consumidores de enormes quantidades de cerveja (que ingerem grande volume de líquido, porém pequenas quantidades de sal e proteína).15 Mais comumente, a hiponatremia é observada em pacientes cuja capacidade de excretar água livre é reduzida.8,12
Comprometimento da excreção da água
A excreção da água obviamente está comprometida na insuficiência renal grave. Pacientes oligúricos se tornam hiponatrêmicos quando recebem água em demasia. Entretanto, a maioria dos casos de hiponatremia ocorre em pacientes cujos rins normais são incapazes de excretar uma urina maximamente diluída. Uma concentração plasmática de sódio patologicamente baixa é observada quando a água é ingerida num momento em que os mecanismos renais de diluição não estão funcionando em sua capacidade máxima, porque (1) o uso de diuréticos ou defeitos de transporte tubular estão bloqueando a reabsorção de sódio nos segmentos diluidores dos rins; ou (2) os níveis de ADH estão elevados.
Liberação não osmótica de vasopressina
A vasopressina é um hormônio retentor de água, que a libera de acordo com a necessidade hídrica do corpo. Como a hiponatremia hipotônica normalmente inibe a secreção de vasopressina, a detecção desse hormônio num paciente hiponatrêmico aponta a possível existência de um estímulo não osmótico para a liberação do mesmo. A ação da vasopressina aumenta a osmolalidade da urina, que pode ser considerada um bioensaio para detecção do hormônio.
Estímulos hemodinâmicos para a vasopressina. Hipovolemia, insuficiência cardíaca e cirrose constituem os estímulos não osmóticos mais comuns para a secreção de ADH.16-18 As anormalidades hemodinâmicas que estimulam a liberação da vasopressina também promovem a reabsorção de sódio pelos túbulos renais. Assim, essas condições resultam na retenção tanto de sódio como de água.
Secreção inadequada de ADH. A liberação não osmótica da vasopressina na ausência de um estímulo hemodinâmico indutor é considerada “inadequada”. Pacientes com síndrome de secreção inadequada de hormônio antidiurético (SIADH) retêm água por causa da liberação não osmótica da vasopressina e de mecanismos de sede anormais. Entretanto, esses indivíduos não apresentam nenhuma anormalidade do equilíbrio de sódio, evidência de depleção de volume nem tendência à formação de edema. Na forma estável, a excreção corresponde à ingesta de sódio.8,12,19,20Devido à retenção da água, a SIADH produz uma expansão de volume branda e subclínica. Qualquer expansão de volume adicional é conseguida com um rápido aumento da excreção urinária de sódio.
Osmostato reajustado. O osmostato reajustado é uma variante da SIADH, comumente observada em pacientes com doença crônica e debilitante. Também é uma característica da gravidez normal. Pacientes com essa condição conseguem diluir a urina normalmente, porém a um ponto de ajuste mais baixo do que nos indivíduos normais. Esses pacientes, dessa forma, são discretamente hiponatrêmicos. Contudo, diferentemente dos outros pacientes com SIADH, não apresentam predisposição à retenção progressiva de água nem requerem restrição dietética de água, entre outras medidas adotadas para o tratamento da hiponatremia crônica.11 O osmostato reajustado, no entanto, pode ser observado em malignidades e, assim como outras causas de SIADH, requer uma avaliação diagnóstica para que sua causa seja determinada.
Perdas urinárias de eletrólitos: dessalinização e hiponatremia
Se a urina estiver concentrada, perdas de sódio e potássio podem contribuir para a patogênese da hiponatremia. A concentração plasmática de sódio pode ser reduzida pela perda de sódio ou potássio, ou, ainda, pelo ganho de água. Entretanto, para diminuir a concentração plasmática de sódio, é necessário perder eletrólitos através da urina em uma concentração maior do que os eletrólitos do plasma. A combinação de níveis elevados de vasopressina (que concentram a urina) e uma elevada taxa de excreção de sódio e potássio pode resultar na produção de uma urina hipertônica. Essa urina hipertônica é capaz de gerar a água livre com a qual o plasma é dessalinizado.
✏️ Responder
Para escrever sua resposta aqui, entre ou crie uma conta.
Perguntas relacionadas
Acerca da divisão do sistema nervoso autônomo, classifique V para as sentenças verdadeiras e F para as falsas: ( ) Sistema Nervoso Simpático e ...
Ciencias Morfofuncionais dos Sistemas Nervoso e Cardiorrespiratório
Discussões sobre Ciências Morfofuncionais
O SNA é dividido em Sistema Nervoso Simpático e Sistema Nervoso Parassimpático, dois conjuntos distintos de nervos que controlam em geral os mesmos...
Ciencias Morfofuncionais dos Sistemas Nervoso e Cardiorrespiratório
Discussões sobre Ciências Morfofuncionais
Materiais relacionados
 1 pág.
1 pág. 6 pág.
6 pág. 1 pág.
1 pág. 1 pág.
1 pág.



Compartilhar