Como se calcula a varição da entropia?? Alguém me ajuda?
Um cubo de gelo de 20g a 0°c colocado numa bacia com água a pressão de 37°C derrete completamente absorvendo calor apenas da água da bacia que se mantém a temperatura constante. Qual a variação da entropia desse sistema? dados: (calor latente de fusão do gelo: Lfg= 3,3.10^5 j. temperatura de fusão do gelo a pressão normal: 273k
💡 1 Resposta
Felipe Oliveira
Calcular a desordem de um sistema pelo cálculo da variação da entropia é algo matematicamente simples, basta utilizar a seguinte fórmula:
ΔS = Sp - Sr
ΔS = variação da entropia de um sistema;
Sp = entropia dos produtos;
Sr = entropia dos reagentes;
Observação: Sempre que utilizarmos a fórmula do ΔS para realizar o cálculo da variação da entropia, utilizaremos como unidade de medida cal/K.mol ou cal.mol-1.K-1
O cálculo da variação da entropia e também o da variação da entalpia de um sistema é utilizado para identificar se um processo químico é ou não espontâneo. Assim, quanto maior o valor da variação da entropia e menor o valor da variação da entalpia (reação exotérmica), maior será a probabilidade de o processo químico ser espontâneo.
Acompanhe agora alguns exemplos de cálculo da variação da entropia de sistemas químicos:
1º) Dada a reação química representada pela equação a seguir:
2 Na2O2 + H2O(l) → 4 NaOH(s) + O2(g)
Calcule o valor da variação da entropia para essa reação tendo como base os valores das entropias de cada um dos participantes, presentes na tabela abaixo.
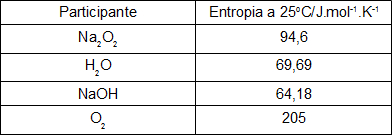
Resolução: Como a variação da entropia deve apresentar como unidade cal/K.mol, devemos inicialmente transformar todos os dados presentes na tabela, pois eles estão em Joule. Para transformar os valores, basta dividi-los por 4,18, pois um cal equivale a 4,18 J.
Não pare agora... Tem mais depois da publicidade ;)
Na2O2= 94,6 = 22,63 cal.mol-1.K-1
4,18
H2O = 69,69 = 16,67 cal.mol-1.K-1
4,18
NaOH = 64,18 = 15,35 cal.mol-1.K-1
4,18
O2 = 205 = 49,04 cal.mol-1.K-1
4,18
Agora basta calcular a entropia presente no reagente e a entropia presente no produto:
- Para os reagentes:
Os reagentes são Na2O2 (contém dois mols na equação) e H2O (contém um mol na equação), logo:
Sr = 2.22,63 + 16,67
Sr = 61,93 cal.mol-1.K-1
- Para os produtos:
Os produtos são NaOH (contém quatro mols na equação) e O2 (contém um mol na equação), logo:
Sp = 4.64,18 + 49,04
Sp = 305,76 cal.mol-1.K-1
Por fim, basta utilizar os valores na fórmula da variação da entropia:
ΔS = 305,76 – 61,93
ΔS = 243,83 cal.mol-1.K-1
2º) A partir da equação que representa a reação de formação do ácido sulfúrico, faça o cálculo da variação da entropia do sistema e determine se ele tende a ser espontâneo ou não, sabendo que sua variação de entalpia é igual a – 4206,66 KJ. Dados: SH20 = 69,9 J/K.mol; Ss8 = 255,2 J/K.mol; So2 = 205,1 J/K.mol; SH2SO4 = 156,9 J/K.mol.
1 S8 + 12 O2 + 8 H2O → 8 H2SO4
Resolução:
Inicialmente vamos calcular as entropias presentes nos reagentes e nos produtos:
- Para os reagentes:
Os reagentes são S8 (contém 1 mol na equação), O2 (contém 12 mols na equação) e H2O (contém 8 mols na equação), logo:
Sr = 255,2.1 + 12.205,1 + 8.69,9
Sr = 3275,6 J/K.mol
- Para o produto:
O produto é o H2SO4 (contém oito mols na equação), logo:
Sp = 8.156,9
Sp = 1255,2 J/K.mol
Agora, basta utilizar os valores na fórmula da variação da entropia:
ΔS = 1255,2 – 3275,6
ΔS = -2020,4 J.mol-1.K-1
OBS.: Para converter a unidade para cal.mol-1.K-1, basta dividir o resultado por 4,18, assim:
ΔS = -2020,4
4,18
ΔS = -483,34 cal.mol-1.K-1
Como o ΔS e o ΔH são negativos, o sistema não tende a ser espontâneo.
✏️ Responder
Para escrever sua resposta aqui, entre ou crie uma conta.
Perguntas relacionadas
Materiais relacionados
 3 pág.
3 pág.




Compartilhar