O que é Constante de Dissociação (pka)?
💡 6 Respostas
Vinicius A. H. Sato
oi Graciana. não sei exatamente qual o contexto da sua pergunta. Mas no geral, em bioquímica, a constante de dissociação é um valor que expressa a relação entre as concentrações dos eletrólitos dissociados em meio aquoso. Como assim? Bom. Isso pode acontecer com ácidos, bases ou sais, por exemplo. Suponha que tenha um ácido de fórmula HA e coloque esse ácido em meio aquoso. O que acontece? ele se dissocia em H+ e A-, certo? a reação fica: {HA -> H+ + A-} a constante de dissociação é a relação entre o que foi dissociado pelo que permaneceu associado (tendo em vista que o ácido nao tem uma dissociação de 100%). assim:
Kd= [H+] x [A-]/[HA]; onde [H=] é a concentração de H+, [A-] é a concentração de A-, e [HA] é a concentração de HA.
Existe uma demonstração matemática para essa fórmula, mas acredito que não seja interessante aprofundar de tal maneira. Se você quiser posso colocá-la aqui para um entendimento mais profundo de onde veio esse Kd (constante de dissociação).
se não foi uma resposta suficiente (não sei exatamente quais suas dúvidas) por favor, me diga.
Gabriel G. Nascimento
A constante de ionização ou constante de dissociação pode ser definida como um valor que expressa a relação entre as concentrações dos eletrólitos dissociados em meio aquoso, ou mais precisamente aplicando a lei da ação das massas podemos afirmar que é o equilíbrio iônico em solução aquosa, de acordo com lei da ação das massas é também um equilíbrio químico onde a dissociação iônica é uma reação reversível.
Assim como as demais constantes de equilíbrio esta constante, nada mais é do que o quociente entre as concentrações dos íons em solução e a concentração do eletrólito.
Para o ácido genérico:
Observe que nesta reação de dissociação chamaremos de Ka a constante de ionização do H+ , quando temos um ácido forte a concentração do íon hidrogênio [H+] é elevada e portanto teremos um alto valor .
Para a base genérica:
Existe um parâmetro que podemos aplicar para definir a força de um ácido que é o grau de ionização (α) ou grau de equilíbrio iônico, que é o quociente entre a quantidade de um reagente que realmete reagiu até o equilíbrio ser atingido e a quantidade de mols do referido reagente. Portanto temos dois fatores que informam a força de um ácido, sendo estes o valor de sua Ka e seu α. Um cientista chamado Ostwald relacionou esses 2 parametros numa lei, a qual chamamos de Lei da Diluição de Ostwald.



Onde:
- αé o grau de ionização
- Ki é a constante de ionização
- M é a concentração molar da solução.
É importante ainda salientar que 1 mol de um ácido ou de uma base durante a ionização libera um mol de cada íon como por exemplo.
- 1mol de HCl= 1mol de H+ e 1 mol de Cl-
- 1mol de H2SO4 = 2 mol de H+ e 1mol de SO4-2
- 1mol de NaOH= 1 mol de Na+ e 1mol de OH-
- 1mol de Ca(OH)2= 1 mol de Ca+ e 2 mol de OH-
Constante de ionização para o Ácido Acético:
Constante de ionização da base Hidróxido de Amônio:
Constante de ionização para um ácido diprótico:
Os estágios de ionização dos ácidos polipróticos ocorrem de acordo com o número de hidrogênios ionizáveis como, por exemplo, o ácido fosfórico, H3PO4 K1,K2 e K3, e assim sucessivamente.
Diogo costa
✏️ Responder
Para escrever sua resposta aqui, entre ou crie uma conta
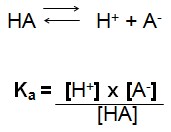
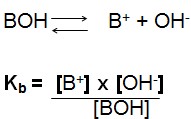
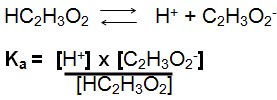
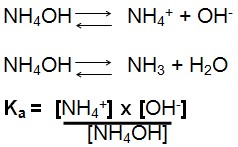
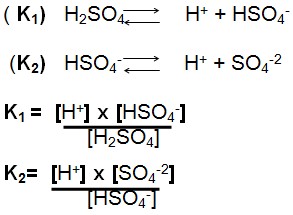






Compartilhar