Polaridade
A molécula de SF4 é polar ou apolar ?
Porque?rs
💡 7 Respostas
Rômulo C Ar
Boa noite Leonardo,
Primeiramente vamos entender o que é uma molécula apolar. Segundo a definição da wikipedia, apolares são todos os compostos que não formam pólos, isto é, não possuem diferença de eletronegatividade, ou possuem-na em níveis muito baixos.
Exemplo: Nas ligações entre o C e o H a diferença de eletronegatividade é muito baixa, não produzindo pólos.
Já nas ligações entre O e o H há uma grande diferença de eletronegatividade formando um pólo positivo e um negativo, por isso dizemos que a molécula da água é polar.
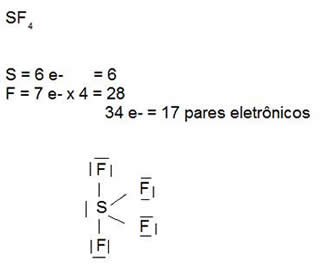
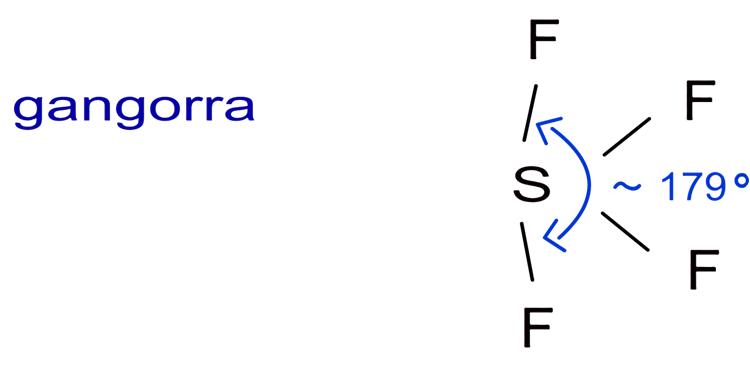
A estrutura do SF4, além de ser tetraédrica, tem a peculiaridade de formar uma gangorra, com um par de elétrons isolados. Em outras palavras, a molécula de SF4 possui geometria de gangorra, com 5 pares de eletrons na camada de valência. Vide a ilustração à seguir:
Agora vamos conceituar o que é o momento dipolar de ligação ou momento de dipolo de ligação. Usa-se a ideia de momento do dipolo elétrico para medir a polaridade de uma ligação química dentro de uma molécula. Ele ocorre sempre que houver uma separação de cargas positivas e negativas. A ligação dipolo μ é dada por:
O dipolo de ligação é modelado como +δ — δ- com uma distância d entre as cargas parciais +δ e δ-. É um vetor, paralelo ao eixo de ligação, apontando do menos para o mais, como é convencional para vetores momento de dipolo elétrico. (Alguns químicos desenham o vetor ao contrário, apontando de mais para menos, mas apenas em situações em que a direção não importa.).
 |
 |
|---|
Leonardo Terra
Ótima resolução. Obrigado.
Mas o que eu não consegui entender é como o momento de dipolo dá zero. :x
Não consegui enxergar a soma vetorial dar zero. Se conseguir me dar uma luz adicional, ficaria mais grato ainda.
Valeu brother :)
✏️ Responder
Para escrever sua resposta aqui, entre ou crie uma conta

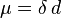








Compartilhar