Como se da o número quântico secundário ?
💡 1 Resposta
Rogério Costa
Dá se por (l), estabelecendo a relação entre os elementos da distribuição eletrônica
franciscobernardo_1745@hotmail.com 26033184
Para resolver este problema, devemos colocar em prática nosso conhecimento sobre Química Geral.
Os números quânticos são dividos em: principal (\(n\)); secundário (\(l\)); magnético (\(m\)) e spin (\(s\)). Sua função é permitir localizar os elétrons e, por essa razão, é impossível que hajam elétrons que possuam os quatro números quânticos iguais.
O número quântico principal denota o nível de energia, ou seja, a camada eletrônica do átomo. A Tabela abaixo associa as camadas a um número quântico
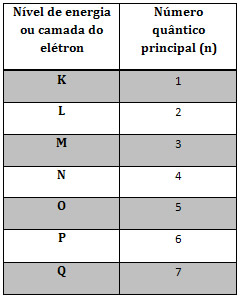
Fonte: https://mundoeducacao.bol.uol.com.br/quimica/os-quatro-numeros-quanticos.htm. Acesso em 01 de junho de 2018.
Por sua vez, o número quântico secundário é aquele que indica o subnível de energia em que o elétron pertence. A Tabela a seguir relaciona os subníveis do elétron com o número quântico secundário.
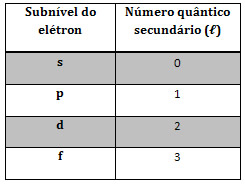
Fonte: https://mundoeducacao.bol.uol.com.br/quimica/os-quatro-numeros-quanticos.htm. Acesso em 01 de junho de 2018.
O número quântico magnético aponta a órbita em que o elétron se encontra. A Tabela abaixo associa aos subníveis os valores de m. Para determinar tal número quântico, deve-se ir preenchendo os orbitais, geralmente representado por quadrados, lembrando que carga orbital comporta no máximo dois elétrons. Sendo cada elétron representado por uma seta, segue-se a Regra de Hund de modo a ir preenchendo todas setas para cima e só depois volta-se preenchendo as setas para baixo.
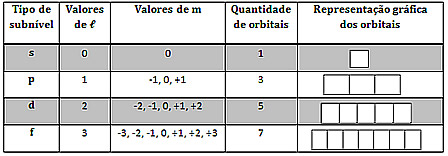
Fonte: https://mundoeducacao.bol.uol.com.br/quimica/os-quatro-numeros-quanticos.htm. Acesso em 01 de junho de 2018.
Por fim, o número quântico de spin indica o sentido de rotação do elétron. Para o processo descrito anteriormente da Regra de Hunt, setas para baixo indicam que \(s=+\dfrac12\) e setas para cima indicam \(s=-\dfrac12\)
Para exemplificar, determinaremos os quatro número quânticos do elétron mais energético do Fluor.
Sabendo que o elemento neutro de Fluor possui \(9\) elétrons, sua distribuição eletrônica é \(1\text s^2 2\text s^2 2\text p^5\). Como elétron mais energético está na camada \(2\), tem-se que o número quântico principal é \(n=2\). Por sua vez, o subnível de tal elétron é \(\text p\), logo, o número quântico secundário é \(l=1\).
Para determinar o número quântico magnético, preenche-se os orbitais seguindo a Regra de Hund, descrita acima:

Fonte: https://mundoeducacao.bol.uol.com.br/quimica/os-quatro-numeros-quanticos.htm. Acesso em 01 de junho de 2018.
Como a última seta desenhada, correspondente ao elétron mais energético, se encontra no \(0\), tem-se que \(m=0\) e, como a seta está para baixo, resulta que \(s=-\dfrac12\).
Logo, os números quânticos do elétron mais energético do átomo de Fluor são \(\boxed{n=2,\text{ } l=1,\text{ } m=0 \text{ e }s=+\frac12}\).
RD Resoluções
Para resolver este problema, devemos colocar em prática nosso conhecimento sobre Química Geral.
Os números quânticos são dividos em: principal (\(n\)); secundário (\(l\)); magnético (\(m\)) e spin (\(s\)). Sua função é permitir localizar os elétrons e, por essa razão, é impossível que hajam elétrons que possuam os quatro números quânticos iguais.
O número quântico principal denota o nível de energia, ou seja, a camada eletrônica do átomo. A Tabela abaixo associa as camadas a um número quântico

Fonte: https://mundoeducacao.bol.uol.com.br/quimica/os-quatro-numeros-quanticos.htm. Acesso em 01 de junho de 2018.
Por sua vez, o número quântico secundário é aquele que indica o subnível de energia em que o elétron pertence. A Tabela a seguir relaciona os subníveis do elétron com o número quântico secundário.

Fonte: https://mundoeducacao.bol.uol.com.br/quimica/os-quatro-numeros-quanticos.htm. Acesso em 01 de junho de 2018.
O número quântico magnético aponta a órbita em que o elétron se encontra. A Tabela abaixo associa aos subníveis os valores de m. Para determinar tal número quântico, deve-se ir preenchendo os orbitais, geralmente representado por quadrados, lembrando que carga orbital comporta no máximo dois elétrons. Sendo cada elétron representado por uma seta, segue-se a Regra de Hund de modo a ir preenchendo todas setas para cima e só depois volta-se preenchendo as setas para baixo.

Fonte: https://mundoeducacao.bol.uol.com.br/quimica/os-quatro-numeros-quanticos.htm. Acesso em 01 de junho de 2018.
Por fim, o número quântico de spin indica o sentido de rotação do elétron. Para o processo descrito anteriormente da Regra de Hunt, setas para baixo indicam que \(s=+\dfrac12\) e setas para cima indicam \(s=-\dfrac12\)
Para exemplificar, determinaremos os quatro número quânticos do elétron mais energético do Fluor.
Sabendo que o elemento neutro de Fluor possui \(9\) elétrons, sua distribuição eletrônica é \(1\text s^2 2\text s^2 2\text p^5\). Como elétron mais energético está na camada \(2\), tem-se que o número quântico principal é \(n=2\). Por sua vez, o subnível de tal elétron é \(\text p\), logo, o número quântico secundário é \(l=1\).
Para determinar o número quântico magnético, preenche-se os orbitais seguindo a Regra de Hund, descrita acima:

Fonte: https://mundoeducacao.bol.uol.com.br/quimica/os-quatro-numeros-quanticos.htm. Acesso em 01 de junho de 2018.
Como a última seta desenhada, correspondente ao elétron mais energético, se encontra no \(0\), tem-se que \(m=0\) e, como a seta está para baixo, resulta que \(s=+\dfrac12\).
Logo, os números quânticos do elétron mais energético do átomo de Fluor são \(\boxed{n=2,\text{ } l=1,\text{ } m=0 \text{ e }s=+\frac12}\).
✏️ Responder
Para escrever sua resposta aqui, entre ou crie uma conta

Compartilhar