Qual a melhor definição de entalpia?
sem copiar de wikipedia e semelhantes
uma definicao clara
💡 5 Respostas
Felipe Ferreira
Entalpia, por vezes referida como entalpia absoluta, é uma grandeza física definida no âmbito datermodinâmica clássica de forma que esta meça a máxima energia de um sistema termodinâmico, teoricamente passível de ser deste removida na forma de calor. É particularmente útil na compreensão e descrição de processos isobáricos 1 : a pressão constante as variações de entalpia encontram-se diretamente associadas às energias recebidas pelo sistema na forma de calor, estas facilmente mensuráveis em calorímetros.
Conforme definida, a entalpia engloba em si não apenas a energia interna do sistema mas também a energia armazenada no conjunto sistema-vizinhança que, absorvida pelo sistema via trabalho realizado pela vizinhança sobre esse em processos termodinâmicos que impliquem a diminuição de seu volume, também integra uma parcela de energia passível de ser extraída na forma de calor a partir do referido sistema. A entalpia mensura pois a totalidade de energia de alguma forma atrelada ao sistema - incluindo-se nesta não apenas a energia encerrada no sistema como também a energia atrelada ao sistema em virtude das relações que este estabelece com a sua vizinhança.
Em acordo com o apresentado, a entalpia absoluta ou simplesmente entalpia, H, define-se por:
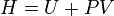
onde U representa a energia interna do sistema e PV mensura a quantidade de energia associada ao conjunto sistema-vizinhança devido ao fato do sistema ocupar um volume V quando submetido à pressão constante P, ou seja, o máximo trabalho executável pela vizinhança sobre o sistema.
Embora as entalpias absolutas - assim como as energias internas absolutas - não desempenhem papel de maior relevância na análise prática de processos físico-químicos - sendo em verdade experimentalmente muito complicadas suas precisas determinações - as variações de entalpia são contudo facilmente mensuráveis via aparelhos conhecidos como calorímetros e estas sim desempenham papel o mais importante na análise dos citados processos. É a variação de entalpia 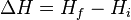 em um dado processo termodinâmico - ou seja, a diferença entre as entalpias do estado final
em um dado processo termodinâmico - ou seja, a diferença entre as entalpias do estado final  e do estado inicial
e do estado inicial  visto ser a entalpia uma função de estado -, e não a entalpia em si, que retém real significado físico e prático: a variação de entalpia mensura o calor absorvido pelo sistema durante os processos termodinâmicos provido que estes realizem-se à pressão constante.
visto ser a entalpia uma função de estado -, e não a entalpia em si, que retém real significado físico e prático: a variação de entalpia mensura o calor absorvido pelo sistema durante os processos termodinâmicos provido que estes realizem-se à pressão constante.
A entalpia-padrão de um sistema corresponde à entalpia do sistema antes descrita subtraída de uma constante adequadamente escolhida de forma a ter-se a entalpia-padrão de um sistema em particular - adequadamente escolhido para constituir um padrão universal de referência - propositalmente definida como zero. A definição de entalpia-padrão faz-se por razões práticas e não acarreta implicação alguma na determinação das variações de entalpia em processos termodinâmicos, visto serem as suas variações iguais às respectivas variações de entalpia absoluta ( ). Assim sendo, define-se de forma universalmente aceita que toda substância simples em estado padrão - ou seja, no estado físico e alotrópico mais estável, a 25°C e 1 atm., tem entalpia-padrão por definição igual a zero - mesmo não sendo nula sua entalpia absoluta em tal estado. Determinar a entalpia-padrão de um estado particular de um sistema consiste pois em determinar a variação de entalpia em um processo qualquer que tenha por estado final o estado em consideração e que tenha por estado inicial sempre o estado padronizado associado. O estado inicial padrão constitui uma referência para a medida de entalpia, e a partir desta referência determinam-se doravante com facilidade as entalpias-padrão de todos os demais compostos químicos ou estados. Em particular, dá-se o nome deentalpia de formação à entalpia-padrão de uma substância pura composta; o que corresponde, dada a aplicação da definição de entalpia padrão ao caso, à variação de entalpia associada à reação que tem por estado inicial os elementos necessários à produção do composto - este em sua forma padrão - e por estado final apenas a substância composta em consideração - nas condições específicas à situação. As entapias-padrão das substâncias compostas - as entalpias de formação - são as entalpias que encontram-se geralmente tabeladas em livros e manuais, não raro figurando junto às variações de entalpias para reações químicas específicas.
). Assim sendo, define-se de forma universalmente aceita que toda substância simples em estado padrão - ou seja, no estado físico e alotrópico mais estável, a 25°C e 1 atm., tem entalpia-padrão por definição igual a zero - mesmo não sendo nula sua entalpia absoluta em tal estado. Determinar a entalpia-padrão de um estado particular de um sistema consiste pois em determinar a variação de entalpia em um processo qualquer que tenha por estado final o estado em consideração e que tenha por estado inicial sempre o estado padronizado associado. O estado inicial padrão constitui uma referência para a medida de entalpia, e a partir desta referência determinam-se doravante com facilidade as entalpias-padrão de todos os demais compostos químicos ou estados. Em particular, dá-se o nome deentalpia de formação à entalpia-padrão de uma substância pura composta; o que corresponde, dada a aplicação da definição de entalpia padrão ao caso, à variação de entalpia associada à reação que tem por estado inicial os elementos necessários à produção do composto - este em sua forma padrão - e por estado final apenas a substância composta em consideração - nas condições específicas à situação. As entapias-padrão das substâncias compostas - as entalpias de formação - são as entalpias que encontram-se geralmente tabeladas em livros e manuais, não raro figurando junto às variações de entalpias para reações químicas específicas.
No Sistema Internacional de Unidades a unidade da entalpia é o joule (J). Ao passo que na literatura a entalpia absoluta é geralmente representada pelo símbolo H, a entalpia-padrão encontra-se geralmente representada pelo símbolo H 0.
Quando expressa em função da entropia S, número de elementos N, e da pressão P - para o caso de sistemas termodinâmicos mais simples - a entalpia  é, assim como o são as respectivas Transformadas de Legendre associadas, a saber a Energia livre de Helmholtz
é, assim como o são as respectivas Transformadas de Legendre associadas, a saber a Energia livre de Helmholtz 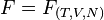 , a Energia livre de Gibbs
, a Energia livre de Gibbs 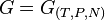 e aenergia interna
e aenergia interna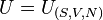 , uma equação fundamental para os sistemas termodinâmicos em consideração. A partir de uma equação fundamental é possível via formalismo matemático inerente à termodinâmica obter-se qualquer informação física relevante para o sistema por ela descrito. Se a entalpia encontrar-se expressa em função de outras grandezas que não as mencionadas, esta constituirá apenas uma equação de estado e não em uma equação fundamental. Uma equação de estado não encerra em si todas as informações acerca do sistema; contudo a partir de todas as equações de estado do sistema é possível deduzir-se uma equação fundamental, e em consequência, viatransformadas de Legendre, todas as demais.
, uma equação fundamental para os sistemas termodinâmicos em consideração. A partir de uma equação fundamental é possível via formalismo matemático inerente à termodinâmica obter-se qualquer informação física relevante para o sistema por ela descrito. Se a entalpia encontrar-se expressa em função de outras grandezas que não as mencionadas, esta constituirá apenas uma equação de estado e não em uma equação fundamental. Uma equação de estado não encerra em si todas as informações acerca do sistema; contudo a partir de todas as equações de estado do sistema é possível deduzir-se uma equação fundamental, e em consequência, viatransformadas de Legendre, todas as demais.
Extraído de Wikipédia. Achei a explicação detalhada e concisa. Espero ter ajudado.
Carlos Alberto Souto
Entalpia (H) é a energia necessária para se criar um sistema termodinâmico, o qual não existia anteriormente. Para que isto seja possível, é necessário adicionar neste sistema um fluido com certa energia interna (U) e para adicionar este fluido neste novo espaço termodinâmico, é necessário "empurrar" o que lá existia, a uma dada pressão (P) e ocupando um volume (V), onde introduziu-se trabalho para isto acontecer, dado por (P.V).
Logo H = U + PV.
Guilherme Rui
A energia absolvida ou liberada em um processo
✏️ Responder
Para escrever sua resposta aqui, entre ou crie uma conta
Perguntas relacionadas
Qual a fórmula do números de aletas retangulares( seção transversal)
Transferência de Calor
•UNISANTA
Martina Almeida







Compartilhar