Respostas
Paulo Victor
Solução é uma mistura homogênea formada por um solvente (material que dissolverá outro) e um soluto (material que será dissolvido). A preparação desse tipo de mistura está diretamente relacionada com uma propriedade física da matéria denominada de solubilidade.
Solubilidade ou coeficiente de solubilidade é a capacidade que um determinado solvente apresenta de dissolver certa quantidade de soluto. Essa capacidade sempre está relacionada com dois fatores:
- quantidade de solvente;
- temperatura.
a) Quantidade de solvente
À medida que adicionarmos uma quantidade maior de solvente à solução e o soluto for dissolvido, poderemos também acrescentar uma quantidade maior de soluto.
Exemplo: 100g de água dissolvem 36 gramas de NaCl. Assim, se tivermos 200 gramas de água, poderemos dissolver 72 gramas de NaCl, ou seja, 36 gramas a mais.
b) Temperatura
A temperatura é o único fator capaz de modificar a solubilidade de um soluto em um determinado solvente sem que a quantidade deste seja alterada. Por exemplo, se o soluto for um gás, sempre haverá uma maior quantidade dissolvida quando a temperatura do solvente for menor, ou seja, quanto mais frio, mais dissolvido será o gás.
Observação: De acordo com o químico britânico William Henry, o aumento da pressão pode favorecer a dissolução de um soluto gasoso em um solvente.
Todavia, se o soluto for um líquido ou um sólido, a mudança de temperatura poderá influenciar de diferentes formas a solubilidade. Dessa forma, há casos em que, quanto mais quente está solvente, mais soluto é dissolvido; e outros em que, quanto mais quente está o solvente, menos o soluto dissolve-se e vice-versa.
A tabela a seguir traz como exemplo dados sobre a variação da solubilidade do NaCl em água em função da temperatura:
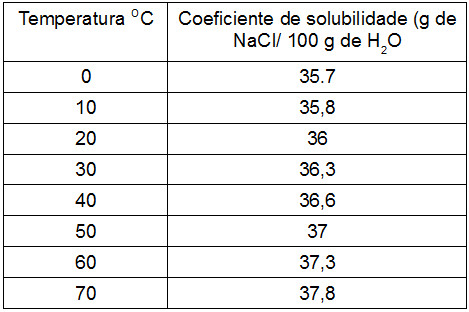
Tabela demonstrando a variação da solubilidade do NaCl em água em função da temperatura
Analisando a tabela, é possível perceber que, quando 100 gramas de água está a 20 oC, pode haver dissolução de 36 gramas de NaCl; mas se a temperatura dessa mesma quantidade de água fosse aumentada para 60 oC, seria possível dissolver 37,3 gramas de NaCl, ou seja, 1,3 gramas a mais sem ter aumentado a quantidade de água.
Não pare agora... Tem mais depois da publicidade ;)
Após o estudo dos fatores que influenciam a solubilidade, é importante ressaltar que sempre que vamos preparar uma solução ou resolver um exercício sobre o assunto, os dois fatores estão presentes e devem ser levados em consideração. Veremos agora a resolução de dois exercícios que envolvem solubilidade.
1º) Determine a massa de nitrato de bário, Ba(NO3)2, que será dissolvida em uma massa de 500 gramas de H2O a 70 oC, sabendo que o coeficiente de solubilidade desse sal em água é de 70 gramas a cada 100 gramas de água a 40oC.
Para resolver esse exercício, basta montar uma regra de três simples com os dados fornecidos, colocando na primeira linha os dados da solubilidade:
100g de H2O-----------70 g de Ba(NO3)2
500g de H2O----------- X
100.X = 500.70
100.X = 35000
X = 35000
100
X = 350 g de Ba(NO3)2 dissolvidos em 500 g de H2O.
2º) A tabela abaixo traz o coeficiente de solubilidade do sulfato de potássio (K2SO4) em gramas a cada 100 gramas de água:

Para resolver esse exercício, basta montar uma regra de três simples com os dados fornecidos, colocando na primeira linha os dados da solubilidade.Determine a quantidade mínima de água, a 50oC, necessária para dissolver totalmente 66 gramas de K2SO4.
100g de H2O-----------16,5 g de Ba(NO3)2
X ----------- 66 g de Ba(NO3)2
16,5.X = 100.66
16,5.X = 6600
X = 6600
16,5
X = 400g de H2O são necessários para dissolver totalmente 66g de Ba(NO3)2.
Responda
Para escrever sua resposta aqui, entre ou crie uma conta




