como calcular questoes de propriedades coligativas?
💡 1 Resposta
Sor Bruno Gracioli
Tonoscopia
É o estudo do abaixamento da pressão máxima de vapor de um líquido, que é ocasionado pela dissolução de um soluto não-volátil.
A pressão de vapor da solução formada por um soluto (não-volátil) em solvente é menor que a do solvente puro, pois a interação entre as partículas do soluto e as moléculas do solvente diminuem as saídas destas últimas. Portanto, quanto maior o número de partículas do soluto em solução, maior o abaixamento da pressão máxima de vapor e menor a pressão de vapor do solvente.
O seguinte gráfico demonstra o efeito Tonoscópico.
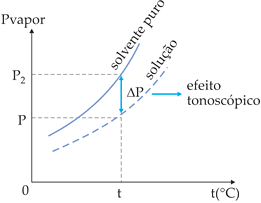
O diagrama mostra o abaixamento da pressão de vapor da solução em relação ao solvente puro, sendo:
- P2 é a pressão de vapor do solvente puro;
- P é a pressão de vapor da solução;
- ΔP = P2 – P é o abaixamento absoluto da pressão de vapor;
- ΔP / P2 é o abaixamento relativo da pressão de vapor.
Crioscopia
É o estudo do abaixamento da temperatura de congelação de um líquido, por meio da adição de um soluto.
A diminuição da pressão de vapor do solvente, devido à adição de um soluto, leva à diminuição da temperatura de congelamento. Quanto maior a concentração do soluto, maior o abaixamento da temperatura de congelamento do solvente e menor a temperatura de congelamento do mesmo.
Δtc = Abaixamento da temperatura de congelamento

Onde temos:
- tc2 = temperatura de congelamento do solvente puro;
- tc = temperatura de congelamento do solvente na solução.
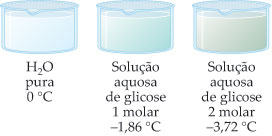
Exemplo 1: Solução aquosa de glicose 1 M, sob pressão atmosférica de 760 mmHg.
Δtc = 0 – (– 1,86)
Δtc = 1,86 °C
Exemplo 2: Solução aquosa de glicose 2 M, sob pressão atmosférica de 760 mmHg.
Δtc = 0 – (–3,72)
Δtc = 3,72 °C
Exemplos de fenômenos que observamos na natureza ou em nosso cotidiano:
A água do mar não se congela em locais próximos aos polos, apesar de nessas regiões se atingirem temperaturas abaixo de 0° C. Isso acontece porque há uma grande quantidade de sais dissolvidos na água. Os icebergs e as camadas de gelo que se formam são feitos de água sem esses sais;

Em países frios, quando o inverno é bastante rigoroso e cai muita neve, é comum jogar sal nas estradas para ela derreter;
Ebulioscopia
É o estudo da elevação da temperatura de ebulição de um líquido, por meio da adição de um soluto não volátil.
A diminuição da pressão máxima de vapor do solvente, devido à adição de um soluto, leva inevitavelmente ao aumento da temperatura de ebulição. Quanto maior a concentração do soluto, maior a elevação da temperatura de ebulição do solvente e maior a temperatura de ebulição do mesmo.
Δte = Elevação da temperatura de ebulição

Onde temos:
- te2 é a temperatura de ebulição do solvente puro;
- te é a temperatura de ebulição do solvente na solução.
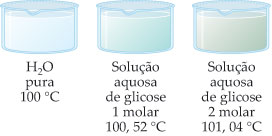
Exemplo 1: Solução aquosa de glicose 1 M, sob pressão atmosférica de 760 mmHg.
Δte = 100,52 – 100
Δte = 0,52 °C
Exemplo 2: Solução aquosa de glicose 2 M, sob pressão atmosférica de 760 mmHg.
Δte = 101,04 – 100
Δte = 1,04 °C
Osmose ou osmometria
Osmose é a passagem de um solvente para o interior de uma solução feita desse mesmo solvente, através de uma membrana semipermeável (MSP). A osmose também é uma propriedade coligativa da solução, pois depende do número de partículas dissolvidas.
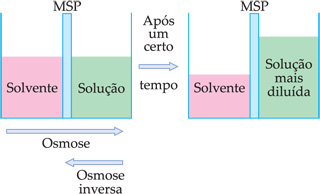
Exemplo: Dadas duas soluções, A e B, inicialmente 0,1 M e 0,2 M, separadas por uma membrana semipermeável.
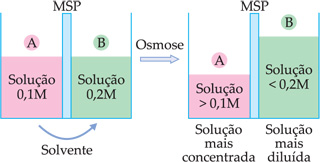
Verifica-se que as soluções A e B mudam de concentração após a osmose.
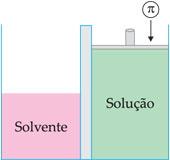
Pressão Osmótica: é a pressão que se deveria aplicar sobre a solução para impedir a passagem do solvente através da membrana semipermeável. A pressão osmótica é representada pela letra grega π. Essa pressão é equivalente à pressão exercida pelo solvente na passagem através da membrana.
✏️ Responder
Para escrever sua resposta aqui, entre ou crie uma conta



Compartilhar