uso da equaçao michaelis mentem
💡 1 Resposta
Kamilla Araújo
O mecanismo mais simples para explicar a acção enzimática é o modelo de Michaelis-Menten:
E +S ↔ ES → E + P
Neste modelo a enzima (E) liga-se ao substrato (S) para formar um complexo enzima-substrato (ES). Este pode separar-se novamente en enzima e substrato livre ou transformar o substrato em produto (P). Como em qualquer reacção elementar (i.e. uma reacção que ocorre por simples colisão entre reagentes), a velocidade de cada passo será proporcional à concentração dos reagentes desse passo. Em cada caso, a constante de proporcionalidade será uma função da energia de activação desse passo. Na maior parte das enzimas, verifica-se que o equilíbrio E +S ↔ ES se atinge muito rapidamente (em poucas dezenas de milissegundos). Uma vez atingido o equilíbrio, a concentração de ES mantém-se constante, uma vez que sempre que um complexo ES se dissocia em produto e enzima livre, esta se liga muito rapidamente a uma nova molécula de substrato, regenerando o ocmplexo ES. Nestas condições, é óbvio que a velocidade de degradação de ES é igual à velocidade da sua formação, ou seja:
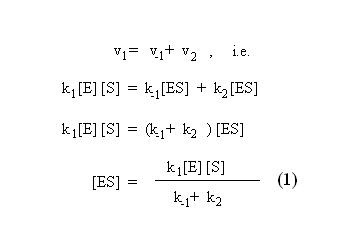
Em princípio, não nos é dado saber em cada momento qual a concentração de enzima que se encontra livre ou sob a forma de complexo enzima-substrato. No entanto, sabemos que a soma das duas concentrações deve igualar a concentração de enzima total (Et). Substituindo em (1)

Se o passo limitante da reacção fôr a transformação do complexo ES em enzima livre e produto, a velocidade da reacção enzimática será:

A expressão pode ser simplificada se juntarmos todas as constantes presentes no denominador numa nova constante: 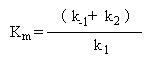 , que é conhecida como constante de Michaelis.
, que é conhecida como constante de Michaelis.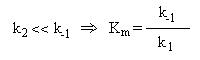 que é também a constante de dissociação do complexo ES. Km é portanto uma medida da estabilidade do complexo enzima-substrato. Substituindo na expressão (2), esta toma assim a forma:
que é também a constante de dissociação do complexo ES. Km é portanto uma medida da estabilidade do complexo enzima-substrato. Substituindo na expressão (2), esta toma assim a forma:

A velocidade máxima da reacção (Vmax) é obtida a concentrações infinitas de substrato:  . Substituindo novamente, obtém-se a forma familiar da equação de Michaelis-Menten:
. Substituindo novamente, obtém-se a forma familiar da equação de Michaelis-Menten:

A representação gráfica da velocidade da reacção em função da concentração de substrato é portanto uma hipérbole. A assímptota horizontal corresponde à vmax. O valor de KM também pode ser obtido através do gráfico, uma vez que quando a [S]=KM , a equação de Michaelis-Menten prevê que a velocidade seja

A constante de Michaelis Menten é portanto a concentração de substrato para a qual a velocidade da reacção é metade da velocidade máxima.
✏️ Responder
Para escrever sua resposta aqui, entre ou crie uma conta
Perguntas relacionadas
Materiais relacionados
 82 pág.
82 pág.



Compartilhar