Respostas
João Paulo do Carmo Cunha
Silmpes! Usa a equação dos gases ideais de Cleyperon 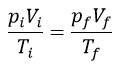
Pf da 2,09 atm
OBS: as temperaturas transformei pra KELVIN
Andre Smaira
\[\dfrac{{{P_1} \cdot {V_1}}}{{{T_1}}} = \dfrac{{{P_2} \cdot {V_2}}}{{{T_2}}}\]
Em que \(P\)é a pressão do gás, \(V\)o volume ocupado pelo mesmo e \(T\)a temperatura.
No problema em questão, temos que:
\[\eqalign{ & \dfrac{{\left( {1,10{\require{text}\text{ atm}}} \right) \cdot \left( {2,30{\require{text}\text{ L}}} \right)}}{{\left( {50{\require{text}\text{ °C}}} \right)}} = \dfrac{{{P_2} \cdot \left( {1,30{\require{text}\text{ L}}} \right)}}{{\left( {75{\require{text}\text{ °C}}} \right)}} \cr & {P_2} = \dfrac{{\left( {1,10{\require{text}\text{ atm}}} \right) \cdot \left( {2,30{\require{text}\text{ L}}} \right)}}{{\left( {50{\require{text}\text{ °C}}} \right)}} \cdot \dfrac{{\left( {75{\require{text}\text{ °C}}} \right)}}{{\left( {1,30{\require{text}\text{ L}}} \right)}} \cr & {P_2} \cong 2,92{\require{text}\text{ atm}} }\]
Portanto, a pressão final do gás será de, aproximadamente, \(\boxed{2,92\require{text}\text{ atm}}\)
Responda
Para escrever sua resposta aqui, entre ou crie uma conta
