QUIMICA ANALITICA ESTACIO R9 TAQUARA AVALIANDO APRENDIZADO
1
QuestãoAcerto: 0,0 / 0,1
A solubilidade molar do iodato de chumbo (II) Pb(IO3)2 a 26°C é 4,0 x 10 -5 mol L-1. Qual o valor da constante do produto de solubilidade para o iodato de chumbo (II)?
 Kps = 2,7 x 10 -13 mol L -1
Kps = 2,7 x 10 -13 mol L -1
 Kps = 6,5 x 10 -12 mol L -1
Kps = 6,5 x 10 -12 mol L -1
 Kps = 1,6 x 10 -12 mol L -1
Kps = 1,6 x 10 -12 mol L -1

 Kps = 1,4 x 10 -14 mol L -1
Kps = 1,4 x 10 -14 mol L -1

 Kps = 2,6 x 10 -11 mol L -1
Kps = 2,6 x 10 -11 mol L -1
Respondido em 09/06/2020 19:57:14
Compare com a sua resposta:
a) C6H5COO- + HOH ⇔C6H5COOH + OH-
NH4+ + HOH ⇔NH4OH + H+
b) NaCℓ → sal proveniente de ácido forte (HCℓ) e base forte (NaOH) não sofre hidrólise;
C6H5COONa → sal proveniente de ácido fraco (C6H5COOH) e base forte (NaOH) ocorre hidrólise do ânion;
NH4Cℓ → sal proveniente de ácido forte (HCℓ) e base fraca (NH4OH) ocorre hidrólise do cátion;
2
QuestãoAcerto: 0,1 / 0,1
Considere o seguinte equilíbrio heterogêneo:
A 800ºC, a pressão de CO2 é 0,236 atm. O valor de Kp para a reação a esta temperatura será de:
 0,472
0,472
 0,056
0,056
 4,237
4,237

 0,236
0,236
 0,708
0,708
Respondido em 09/06/2020 19:54:39
Compare com a sua resposta: Sim, o produto iónico é maior do que o Ksp(BaSO4).
3
QuestãoAcerto: 0,1 / 0,1
(UNIFOR-CE) São colocados 8,0 mols de amônia num recipiente fechado de 5,0 litros de capacidade. Acima de 4500C, estabelece-se, após algum tempo, o equilíbrio:
2 NH3(g) ⇌ 3 H2(g) + N2(g)
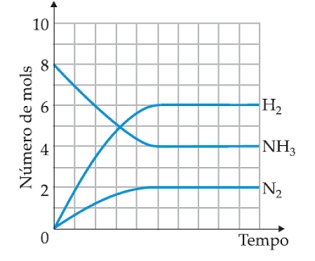
Sabendo que a variação do número de mols dos participantes está registrada no gráfico, podemos afirmar que, nestas condições, a constante de equilíbrio, Kc, é igual a:
 3,20
3,20
 5,40
5,40
 2,16
2,16

 1,08
1,08
 27,00
27,00
Respondido em 09/06/2020 19:55:37
Compare com a sua resposta:
a) CO e H2O - reagentes
b) 825 oC
4
QuestãoAcerto: 0,1 / 0,1
Um solução saturada de Ag3PO4, a 25°C, contém 1,2 miligramas desse sal por litro de solução. Assinale a alternativa que apresenta, respectivamente, as concentrações, em mol/L, dos íons Ag+ e PO43- e o valor da constante produto de solubilidade (Kps) do Ag3PO4.
Massas molares: Ag = 107,9 g.mol-1; P = 31,0 g.mol-1; O = 16,0 g.mol-1.
 2,9 x 10-6, 2,9 x 10-6 e 7,1 x 10-23
2,9 x 10-6, 2,9 x 10-6 e 7,1 x 10-23 8,7 x 10-6, 2,9 x 10-6 e 7,6 x 10-11
8,7 x 10-6, 2,9 x 10-6 e 7,6 x 10-11 2,9 x 10-6, 8,7 x 10-6 e 8,4 x 10-12
2,9 x 10-6, 8,7 x 10-6 e 8,4 x 10-12 2,9 x 10-6, 2,9 x 10-6 e 8,4 x 10-12
2,9 x 10-6, 2,9 x 10-6 e 8,4 x 10-12
 8,7 x 10-6, 2,9 x 10-6 e 2,0 x 10-21Respondido em 09/06/2020 19:56:42
8,7 x 10-6, 2,9 x 10-6 e 2,0 x 10-21Respondido em 09/06/2020 19:56:42
Compare com a sua resposta:
a) CO2(g) + H2O ⇄ HCO3-(aq) + H+(aq)
Com a hiperventilação, há a remoção do gás CO2(g) dos pulmões, o que leva a um consumo do H+(aq), fazendo o pH do plasma aumentar.
b) Ka= [CH3CH(OH)COO-] [H+] / [CH3CH(OH)COOH] = 1,4 x 10-4
1,4 x 10-4 = [CH3CH(OH)COO-] x 5,6 x 10-8 / [CH3CH(OH)COOH]
[CH3CH(OH)COO-] / [CH3CH(OH)COOH] = 2.500
Portanto, a espécie predominante é o lactato, CH3CH(OH)COO-
5
QuestãoAcerto: 0,1 / 0,1
Considerando o Kps do Cd(OH)2 = 4,5E-15, assinale a alternativa que apresenta a mínima concentração de íons hidroxilas, em mol/L, necessária para iniciar a precipitação do Cd (II) a partir de uma solução de CdSO4 com concentração de 0,050 mol/L.
 4,5E-7
4,5E-7 5 E-5
5 E-5
 3 E-7
3 E-7 5 E-8
5 E-8 3 E-8Respondido em 09/06/2020 19:56:57
3 E-8Respondido em 09/06/2020 19:56:57
Compare com a sua resposta: a) P(NO) = 1,53 atm; P(H2) = 11,37 atm; P(N2) = 0,465 atm; P(H2O) = 3,39 atm b) Keq = 1,77 x 10^(-2)
💡 1 Resposta
✏️ Responder
Para escrever sua resposta aqui, entre ou crie uma conta







Compartilhar